| Çayın
Flavan 3 ols
İçeriği Flavonoidler
Doğada ki flavonoidler polifenoliktir. Polifenoller, aromatik bir halka biçiminde bir veya daha çok hydroxyli geçici bir süre içeren maddelerdir. Fenolik maddeler genellikle suda çözünür ve sık sık glikozid gibi bir şeker ile birleşmiş ve genellikle vakuolde yerleşmiştir. Flavonoidler, yapısı bilinen fenoliklerin binlerce büyük grubundandır. Ancak basit monocyclic fenoller, phenylpropanoidler ve fenolik quinonlar ayrıca daha boldur.Bitkilerdeki polimerlerin bir kaçı, ayrıca doğada ki polifenolikler yani ligninler, melaninler ve taninlerdir. Fenolik birimlere ayrıca protein, alkoloid ve terpenoidlerde de rastlanır (1). 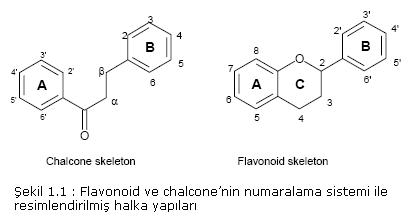 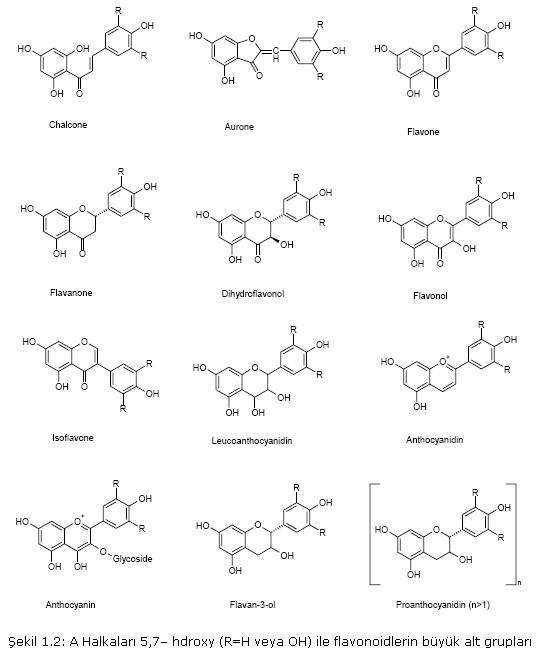 Flavonoidlerin
tüm yapıları, ana madde flavoneden türemiştir. Flavonoidler
çoğunlukla suda
çözünen bileşiklerdir. Flavonoidler %70'lik
etanol ile ekstrakte edilebilir ve
sonra bu ekstraktın sulu fazı petrol eteri ile bölünerek
kaldırılacaktır. Onlar
doğal fenolikler olduğundan dolayı, flavonoidler amonyak ile veya baz
ile muamele
edildikleri zaman renkleri değişir. Flavonoidler ayrıca
şiddetli UV ile uygun
absorblama yapan birleşik sistemler de görülürler (1). Flavonoidlerin
15 Clu
temel birimi üç karbon zinciri ile bağlanmış (A ve B)
iki benzen halkasından ibarettir. Heterocyclic zincir
formunda ki (C) (Şekil
1.1) çoğu flavonoidlerde C zincirlerinin oksidasyonuyla
genellikle ana
sınıflara bölünmüşlerdir (2).
Şekil 1.2 de flavonoidlerin daha
büyük alt grupları görülmektedir.
Flavonoid Biyosentezi : Diğer
bitkilerde ki
flavonoid mekanizması üzerinde
daha çok çalışma yapılmış olmasına rağmen, çayda
ki diğer polifenolikler ve
flavon3olsun metabolizması üzerinde çok az detaylı bilgi
mevcuttur.Çayda ki
flavonoid metabolizmasından anlaşılanın çoğu, diğer bitkilerin
metabolizmasından yapılan varsayın üzerinde temellenmişti (3).
Bununla birlikte
ileri
sürülen yolarla, literatürdeki bilgi arasında
büyük sapma bulunmamıştır. Birinci
bölümde flavonoid metabolizması üzerindeki
takdim, flavonoid metabolizmasının genel bir tanımlaması
olacaktır. İkinci
bölüm çay bitkisin de varsayılan flavonoid
metabolizması üzerinde olacaktır. Son olarak çay
yapraklarında ki farklı flavon3ols bileşiklerinin sentez
sürecinden sorumlu adım lar tartışılacaktır.
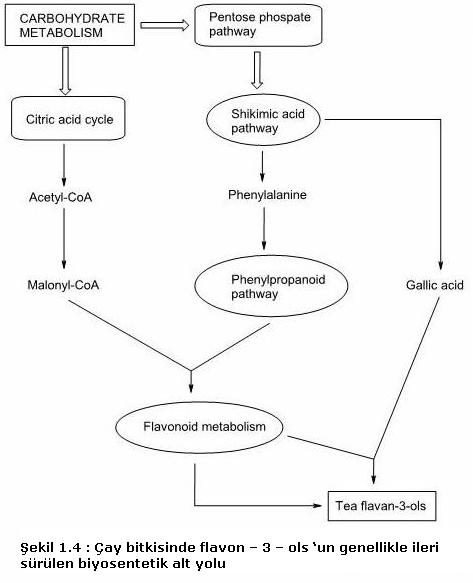
Genel Flavonoid Biyosentezi : Flavonoidler ayrıca ikinci metabolitler olarak da bilinir. İkinci metabolitlerin tüm bileşikleri üretici organizmaların büyümesi ve yaşaması için tümüyle gerekli değildir. Diğer bir ifadeyle, ikinci metabolit bir yolla elemine edilmişse (bir mutasyon ile) organizma büyümeyi sürdürecektir. İkinci metabolizmaların biyosentezinde, birinci metabolitlerden sınırlı bir sayıda yararlanılır. İkinci metabolizmada 4 temel alt yol vardır; -izopren alt yolu, -polyketide alt yolu, -shikimate alt yolu - amino asit alt yolu (şekil 1.3) (4). Tartışmalar dan sonra anlaşıldığı gibi, shikimate ve amino asit alt yolları, çay flavon3olsun metabolizması üzerinde önemli etkiye sahiptir. 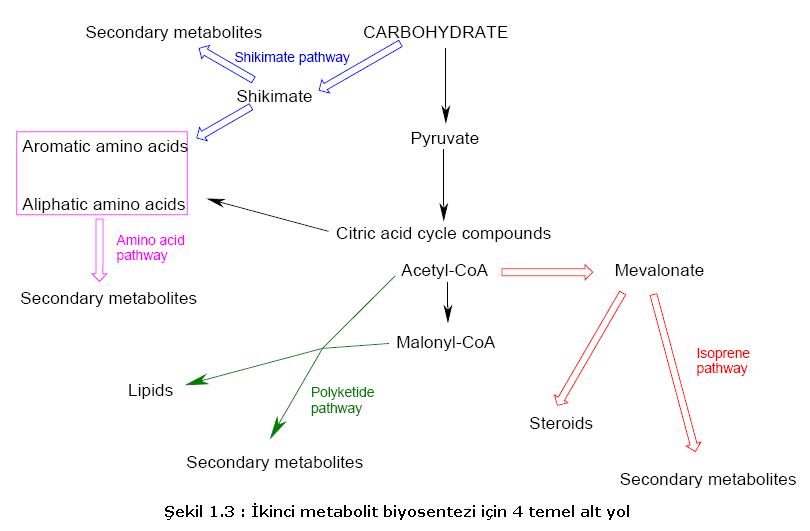 Flavonoidlerin biyosentezi, karbonhidrat metabolizmasından başlar. Shikimate alt
yolu, phenylpropanoid yolu sayesinde flavonoid yolunun
öncüsü olan
phenyllalaninenin sentezi sürecinden sorumludur, ki o çay
flavon3olsun biyosen tez işleminin
son
aşamasında bir ester ile birleşip flavon3 olse bağlanmış
olacaktır.
Bununla birlikte manoly Co enzyme A (- CoA) flavonoid biyosentezi
için diğer
bir öncüdür. Bu bileşik, acetyl CoA dan
sentezlenmiştir, ki o citric asit
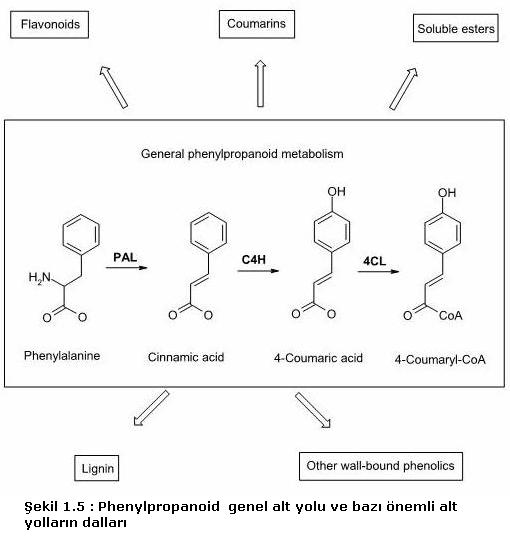
zincirinden kaynak lanır (şekil 1.4) (5). Phenylpropanoid
alt yolu, flavonoidlerde dahil bitkilerdeki fenolik bileşiklerin
büyük bir
miktarda biyosenteze verildiği ilk aşamadır.Genellikle
phenylpropanoid
alt
yolu phenylallanin ile başlar ve 4 Coumaryl CoA ile sonlanır (6).
Phenylpropanoid alt
yolu bununla birlikte bileşiklerin
bütün
bir sırası için öncüler üretir. Bu bileşiklerin
fonksiyonları yapısal
varyasyonları kadar çeşitlidir, bitki mikrop
interaksiyonlarında göze
çarpan moleküller ile böcek kovucuları,
UV koruyucuları, phytoalexins
(saldırı altındaki bitkiler tarafından üretilen
antibiyotikler ) ve çiçek pigmentlerini kapsar. Bu
bileşikler ayrıca yapısal
polimerler gibi çalışır suberin,
lignin
ve diğer hücre duvarı bileşenleri gibi (şekil 1.5 ) (7).
 Phenylpropanoid
yolunda ilk enzimatik reaksiyon, phenylallanine
ammonia lyase (PAL)
vasıtasıyla cinnamic asit üretmek için phenylallaninenin
deaminasyonudur. Bu
enzim aynı zamanda çeşitli alt yolların akış
yönünün oluşumu için önemli bir
düzenleyici enzimdir. Çeşitli bitki türlerinde
küçük bir multi gen ailesi
tarafından kodlanmış olan PAL genine sahip oldukları
görülmüş tür (8).
PAL aktivitesi aslında gen anlamı
seviyesinde
düzenlenmiştir. Bununla birlikte, PAL fosforilasyonla ve enzim
aktivasyonuyla
phenylpropanoid yolunun dallarında üretilmiş ürünler
yoluyla geri beslemeyi
yavaşlatma veya aktive etme yoluyla düzenleme yapmış olduğu ayrıca
görülmüştür. PAL
aktivitesi bitkilerin gelişme
aşamasında ve yaralar, enfeksiyonlar, çevresel uyarıcılar (UV
ışığıda maruz
kalmakta dahil ) gibi faktörler tarafından düzenlenmiştir (9).
Türlerin bir çoğu için çeşitli isoform ları
bulunduğu ayrıca görülmüştür (10).
 PAL enziminin çayda flavon3 ols ün biyosentezinde ayrıca önemli olduğu görülmüştür. Sangwan ve Ravindranath 1997 çayda ki toplam fenolikler ve tyrosine ammonia lyase (TAL) ile PALın enzim aktiviteleri arasın da pozitif bir korelasyon görmüştür. Bunu yılın farklı büyüme sezonları süresince farklı çay klonlarında ki PAL aktivitesi ve toplam fenolik içeriğini denetleme yoluyla belirlemiştir. Diğer bir araştırma çay bitkisinin farklı bölümlerinde ki kateşin içeriği ve PAL enzim aktivitesini ölçme yoluyla bu korelasyonu ayrıca belirlemişlerdir (11). Farklı çay klonlarında kateşin içeriği ve PAL aktivitesi arasında pozitif bir korelasyon ölçülmüştür (11). Gölgeye maruz kalmış çay klonlarında ki çay yapraklarının kateşin içeriğinde bir azalma belirlenmiştir, ki o ayrıca çay yapraklarında ki PAL aktivitesinde ki azalma ile de aynı zamana rastlar (12). Çay yapraklarında ki kateşin ve Pal aktivitesi arasında ki pozitif korelasyon için böyle çeşitli kanıtlar vardır. PAL geni çay için sınıflandırılmış ve klonlanmıştır (13). RFLP polymorphism restriction fragment length yöntemiyle çay bitkilerinin PAL genlerini araştırmada cDNA çay PALı kullanılmıştır. Assam hibritlerinin çoğunda görülen daha çok sayıda PAL hybridization bantlarından kaynaklarda önceden belirtilen PAL genetik varyasyonunun çok yüksek oldu ğu görülmüştür. Diğer bir yöntem de, Japon yeşil çayının yetiştirildiği C.sinensis varyetelerini beş gruba bölmek yararlı olabilir. Çay haploid genomu içinde PAL geninin günümüzde tek bir gene karşılık olduğu sonucuna varılmıştır. RFLP analizlerinden ayrıca yetiştirilen Japon yeşil çayı ve Assam hybridlerinde ki yük sek ve düşük kateşin içeriği arsında farkları görmeyi başarmışlardır. Flavonoid alt yolunda, chalcone sentez enzimi (CHS) yoluyla (4,2,4,6 tetrahydroxychalcone) arada bulunan C 15 chalconenin sentezi birinci adımda verilmiştir. Şekil 1.6 da açıkça flavonoid bileşiklerinin görülmesinin amaçlandığı vurgulan mışsa da, bununla birlikte sadece flavonoid sınıflarının isimleri şekil 1.6 da görülmektedir. Bu reaksiyon bir CoA ester hydroxycinnamic asit (genel olarak 4 coumaroly CoA) ile üç malonyl CoA molekülünün yoğunlaşması yoluyla meydana gelir. Sonraki reaksiyon flavanone3 hydroxylase, dioxygenase ile üç yerde hidroksilasyonu direkt katalizler. Dihydroflavonol 4 reduktaz ile dört yerde karbonil grubunun redüksiyonu yoluyla leucoanthocyanidinler için öncü dhydroflavonol (dhydrokaemp- fenol) oluşmuştur. Oluşmuş leucoanthocyanidin şekil 1.6 da ki leucopelargoni din dir. Proanthocyanidinler ve (ayrıca kateşinler olarak bilinen) flavon3olsün oluşması için direkt öncüler leucoanthocyanidinlerdir. Flavon3 ols şekil 1.6 da ki aflesechin) flavon 3,4 cisdiol reductaze enzimi yoluyla oluş muştur. Bununla birlikte, anthocyanin (pelargonidin 3 glucoside) ve anthocyanidin (pelargonidin) önemli sınıfları için leucoanthocyanidinler ayrıca öncülerdir. Leucoanthocyanidin den, anthocyanidinlere kadar ki reaksiyonlar hala bilinmiyor. Anthocyanidinler çok durağan değildir ve genellikle durağan formda ki bir anthocyanidine, anthocyanidinin üç yerinde glycosylation ile bir glikozid (genellikle glikoz) transfer eder. Bu reaksiyon UDP glukose flavonoid 3 0 glycosytransferaze tarafından katalizlenmiştir. 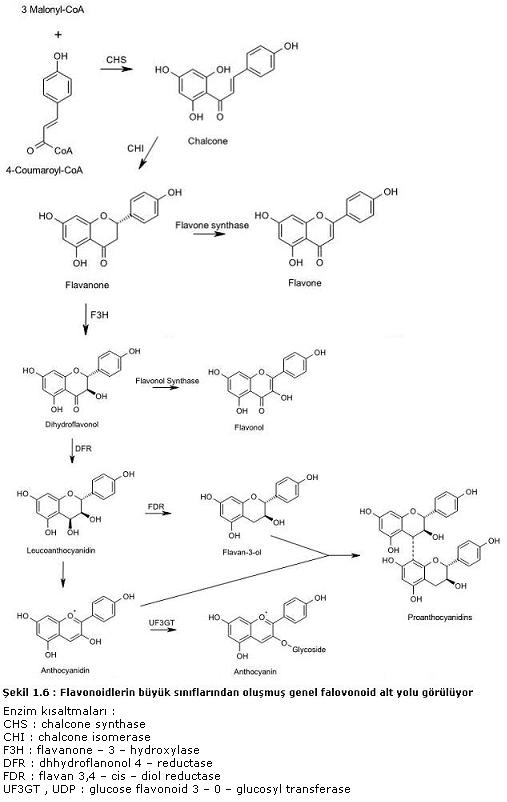 Flavonoid
metabolizması süresince oluşan diğer iki önemli sınıf
flavonlar ve
flavanollerdir. Flavonlar (e.g apigenin) flavon sentez enzimi
tarafından bir
flavanonda C-2 den C-3 e kadar çift bağ oluşumu ile
tanımlanmıştır. Flavonoller
(kaempfrol), flavonol sentez enzimi yoluyla C-2 ve C-3 arasında ki
bir çift
bağın tanımlanması yoluyla dhiydroflavanoller den sentezlenmiştir (14).
5,7 hydroxy A
halkasoyla
2,3 trans stereokimyasalı ve flavan3 ols için genel
biyosentetik alt yol
iyi bilinmektedir. O, chalconenin sentezi ile başlar ve
chalcone izomeraz
enziminden 2R stereokimyasalının tam
stereo
spesifikliğine
kadar ve falavanon naringen den chalcone izomeraza kadar. Sonra 2,3
trans
dhydroflavonol formuna üç yerde bir hydroxyl grup
bağlanmıştır. Bunu bir flavan
3, 4 diol birinci sentezine kadar flavon 3, 4 cis diol
redüktaz ve
dihydroflavonol 4 edüktaza iki NADPH redüktaz bağlanması
izlemiştir. Şekil
1.7 de bu alt yol flavanon düzeyinde görülmektedir, 6
faklı bileşiğin bir
karışımın dan oluşmuştur, yani; (+)- catechin, (+)- gallocatechin,
(-) -
epicatechin, (-) - epicatechin gallate, (-)- epigallocatechin ve (-) -
epigallocatechin gallate. Flavan3 ols de oluşan bu fark B halkası
üzerinde
ki hydroxyl gruplarının sayları ve C3ün stereokimyasında 3
hydroxyl grubuna
ekstra bir galloylun eklenmesindendir.
Flavan3 ols de 2,3 cis konfigürasyonunda üretimin metodu bu noktada bilinmemektedir. Stafford (1990) 3,3 cis flavon3 ols ün oluşumu için iki olasılık ileri sürmüştü. İlk olasılık, flavanon 3 hydroxylase yoluyla hidroksilasyon sürecinde α 3 hidroksilasyon aldığıdır. Bu hipotezi 2,3 cis flavon3 ols üretiminin sadece bitkilerde olması desteklemiştir. İkinci olasılık, 2,3 trans stereokimyasalını 2,3 cis konfigürasyonuna kadar hydroxyflavanone epimeraz enziminin değiştireceği olgusudur. Doğal bir ürün olarak dihydroquercitinin 3 glycoside nin 2,3 cis isomerin tanımlanmadıklarından dolayı 3,4 diol düzeyinde bir epimerizasyonun bir adımı oldukları düşünül memiştir. Çayda 2,3 cis ve 2,3 trans izomerler bağlı olduğundan dolayı, çay flavon3 ols ün biyosentetik alt yolunda bir epimeraz enziminin hazır bulunduğundan şüphelenilecektir. Çay yapraklarında falavon3olsün tipik görünüşü denetime kapalıdır, bununla birlikte çoğunlukla 2,3 cise sahip olanlara yakınlık gösterir. Flavanon 3 hidroksilasyon basamağında 2,3 cis stereokimyasalına kadar ki bu değişim gösterilebilmektedir. 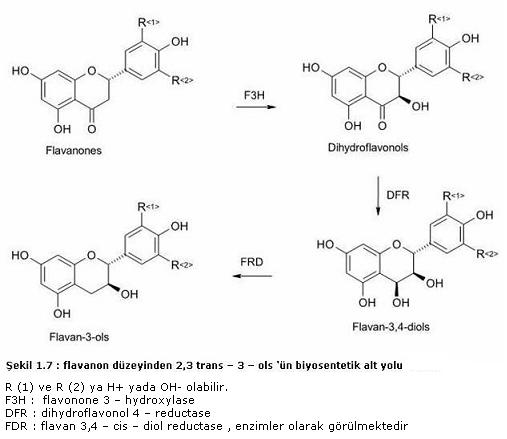 Çay
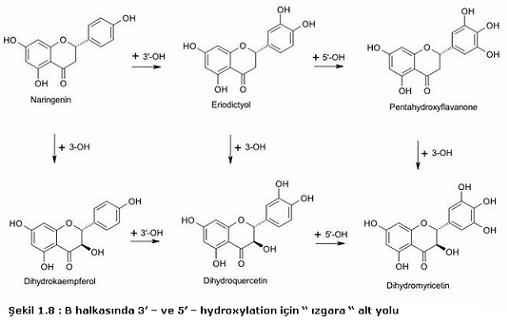
flavon 3 ols ayrıca B halkasının hidroksilasyonunun derecesine
göre farklı
olur. Çay flavon 3 ols diğer bir dihodroxy B halkası (C,
EC, ECg) veya
bir trihydroxy B halkasına ( GC, EGC, EGCg ) sahip olabilir. Chalcone
sentezi
tarafından öncü olarak kullanılmış 4 coumaroly CoA dan
grup 4 hydroxyl
dir. 3 ve 5 hydroxyl grubları
genellikle
flavonoid alt yolu süresince 3 hydroxyl grubu eklenmiş olabilir,
bununla
birlikte diğer bitkilerin falvonoid metabolizmasından bunun çok
yüksek olmadığı
görülmektedir. 3 ve 5 hydroxly grupları
genellikle
ızgara alt yolu olarak isimlendirilmiş C 15 düzeyi içinde
eklenmiştir (15). C
halkasının
hidroksilasyonu için kendine özgü hydroxylaseden, B
halkası için kendine özgü
hydroxylase tamamen farklıdır. B
halkası
aromatik iken , C halkası aromatik değildir. Bununla birlikte diğer
halkaların ( B ve C halkası ) hidroksilasyon modeli özel
reaksiyonlarda
karmaşık değildir, onların spesifikliği enzimlerin benzerliği
yönündedir. Bu
yöntemde 3 konumda bit hydroxyl grubun bulunması veya bulunmaması
için 3 ve 3 , 5 hydroxylase spesifik
değildir.
Ve 3 ve 3 , 5 hydroxyl gruplarında
bulunma
veya bulunmaması için F3H spesifik değildir. Bundan, şekil
1.8de görülen
ızgara alt yolu sorumludur, ki bu şekilde üç alt yol
tarafından
dhiyromyricetin ve iki alt yol tarafından dihyroquercetin
üretilmiş olur.
Tercüme:
Kamil Engin İSLAMOĞLU, Ziraat Mühendisi, E-Mail
Kaynak : Wright, L.P. 2005 Biochemical analysis for idendification of quality in black tea (Camellia sinensis). Faculty of Natural and Agricultural Sciences Department of Biochemistry University of Pretoria. South Africa. Page 19 31. 1) Harbone, 1998 2) Strafford, 1990 3) Magoma, et al, 2000 4) Bently, 1999 5) Chu and Juneja, 1997 6) weisshaar and Jenkins, 1998 7) Hahlbrock and Scheal, 1989 8) Liang et al, 1989 ; butland et al, 1998 9) Liag et al, 1989 10) Sarma et al, 1998 11) Iwasa, 1977 12) Iwasa, 1977 ; Saijo, 1980 13) Matsumoto et al, 1994 14) Heller ve Forkman, 1988; Stafford,1990; Dooner et al, 1991 15) stafford, 1990 ; Stotz et, al. 1984 ; stick and Forkman 1987 ; Holton et, al. 1993 ; Menting et al. 1994 ; Nielsen and Podivinsky ,1997 |